RNA分子能够折叠成复杂多变的结构,对转录后调控和非编码RNA执行特定功能至关重要[1]。活细胞内部RNA结构检测技术是解析RNA结构如何参与调控各项生理过程的基础。然而现有的RNA结构检测技术不仅操作繁杂,还对RNA起始量有着很高的要求,这一局限性使得我们很难利用现有的技术对数量稀少的样品进行RNA二级结构检测。
2022年1月24日,bevictor伟德官网张强锋组和bevictor伟德官网医学院/免疫学研究所胡小玉组联合在《自然科学基础研究》(Fundamental Research)杂志上发表了题为“超低起始量全转录组RNA二级结构测量新方法揭示巨噬细胞中Regnase-1调控机制(An ultra low-input method for global RNA structure probing uncovers Regnase-1-mediated regulation in macrophages)”的研究文章[2]。该工作介绍了一种超低起始量的RNA二级结构检测的新技术smartSHAPE(图1)。smartSHAPE通过结合随机引物逆转录和磁珠上文库构建的策略提高了文库构建的效率;此外,该方法还引入了RNase I消化步骤,进一步提高RNA结构数据的信噪比。smartSHAPE技术只需要1ng RNA作为起始量就能获得全转录组水平高精确度的RNA结构数据。
接着,研究人员利用smartSHAPE在全转录组水平上检测小鼠肠道巨噬细胞中RNA的二级结构,这也是首个在全转录组水平研究哺乳动物原代免疫细胞中RNA二级结构的工作。通过构建柠檬酸杆菌感染的小鼠肠道炎症模型,研究人员从小鼠肠道中分选出两种处于不同免疫状态的巨噬细胞, Ly6Chi 和Ly6Clow 细胞。通过比较这两种巨噬细胞RNA二级结构的差异,研究人员发现这些具有结构差异的转录本富集在与免疫应答相关的基因上,表明RNA结构可能参与了免疫应答相关的调控。
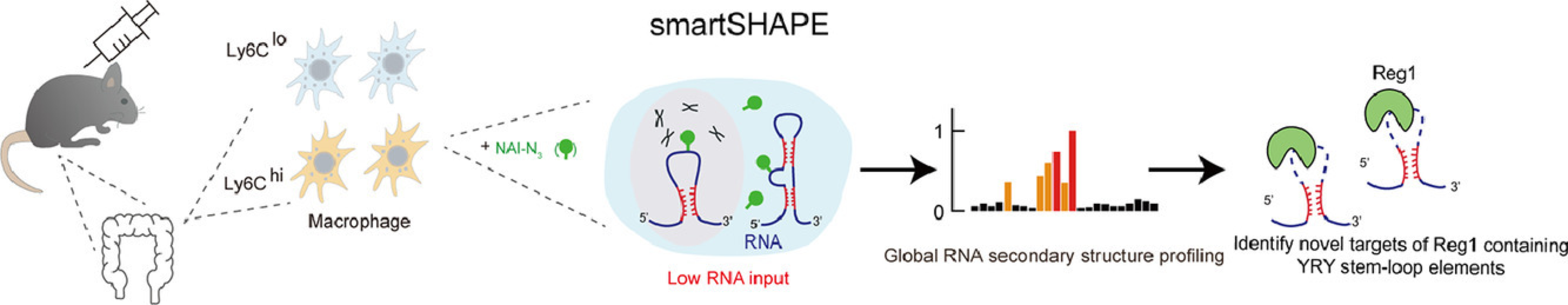
图1. 使用smartSHAPE对小鼠巨噬细胞进行RNA二级结构检测
另外,巨噬细胞受刺激后表达一类细胞因子,编码这些细胞因子的mRNA 3’非编码区域存在含有YRY (R: A或G, Y: C和U)的茎环结构。该结构能够招募RNA内切酶Regnase-1迅速降解该基因,从而抑制免疫应答[3]。为了进一步系统性研究RNA结构在免疫应答过程中的转录后调控作用,研究人员开发了一套新的计算流程,利用巨噬细胞的smartSHAPE结构数据预测出上千个潜在YRY茎环结构,并通过一系列实验证明含有这些结构元件的转录本能够被Regnase-1调控,为进一步深入研究巨噬细胞RNA二级结构奠定了良好基础。
伟德国际victor1946/结构生物学高精尖创新中心/北京市生物结构前沿研究中心/清华-北大生命科学联合中心张强锋副教授和bevictor伟德官网医学院/免疫学研究所的胡小玉教授为该文章的通讯作者。bevictor伟德官网张强锋组博士毕业生朴美玲、李盼,胡小玉组基础医学专业博士生曾小敏,张强锋组博士后王茜雯为该文章的共同第一作者。胡小玉组已毕业的康兰博士为该工作做出了重要贡献。北京大学未来技术学院汪阳明教授也在该工作中给予了大力的支持和帮助。该研究工作获得了国家科技部重点研发计划、国家自然科学基金委、北京市结构生物学高精尖创新中心及北京市生物结构前沿研究中心、生命科学联合中心、bevictor伟德官网免疫学研究所的资助。
文章链接:https://www.sciencedirect.com/science/article/pii/S2667325821003113
相关论文
1. X. W. Wang, C. X. Liu, L. L. Chen, et al., RNA structure probing uncovers RNA structure-dependent biological functions. Nat Chem Biol, 2021. 17(7), 755-766.
2. M. Piao, P. Li, X. Zeng, et al., An ultra low-input method for global RNA structure probing uncovers Regnase-1-mediated regulation in macrophages. Fundamental Research, 2022. 2(1), 2-13.
3. T. Mino, Y. Murakawa, A. Fukao, et al., Regnase-1 and Roquin Regulate a Common Element in Inflammatory mRNAs by Spatiotemporally Distinct Mechanisms. Cell, 2015. 161(5), 1058-1073.