在生命起始的时候,高度特化的精子和卵子结合形成全能性的受精卵。在这一过程中,表观遗传信息发生了广泛而剧烈的重编程。同时,一些表观遗传信息如基因印记会被选择性的保留下来。由于哺乳动物配子和早期胚胎材料的稀缺,关于表观遗传信息在配子向胚胎转变(parental-to-embryonic transition)过程中是如何遗传和重编程的研究长期进展缓慢。近年来,由于一些高灵敏微量细胞染色质分析技术的出现,研究人员得以在分子水平研究表观遗传信息在生命起始过程中是如何擦除、重建和遗传的。这些研究大部分是在模式动物尤其是小鼠中展开的。但是,在不同物种中,表观遗传信息的传递是否保守,以及不同物种中是否存在普适的表观遗传调控规律调控胚胎发育并不清楚。
为了回答这个问题,bevictor伟德官网颉伟课题组、北京农学院郭勇课题组与中国科学院动物研究所李伟课题组紧密合作,利用一系列表观遗传的分析技术,包括STAR ChIP-seq、CUT&RUN、STEM-seq,研究了人、牛、猪、大鼠和小鼠5个物种配子和早期胚胎中DNA甲基化组,以及一些重要的组蛋白修饰,包括H3K4me3、H3K27me3、H3K36me2和H3K36me3的模式和代间传递。通过整合不同维度的表观基因组信息并结合转录组数据,系统阐述了不同哺乳动物早期胚胎发育中表观遗传信息重编程的保守性和物种特异性。研究发现,没有一个单一物种的表观遗传重编程过程与人类完全相似。因此其他物种中得到的信息可能不能简单地外推至人类自身。在啮齿类动物(大鼠和小鼠)的卵母细胞中,DNA甲基化,包括母源印记区的DNA甲基化,是以一种转录依赖的模式建立的。但是,在人、牛和猪,尤其是后两者的卵母细胞中,转录和非转录区域都可以观察到广泛的高甲基化状态。牛和猪卵母细胞中的高DNA甲基化状态与H3K36me2和H3K36me3高度相关,这两种都是已知的在小鼠配子发生过程中可以介导DNA甲基化的组蛋白修饰。但是出乎意料的是,牛和猪卵母细胞中的H3K36me2和H3K36me3分布非常类似,这与啮齿类动物中的情况不同,表明不同物种卵子中DNA甲基化从头建立的机制既有保守性也存在物种特异性。虽然牛和猪卵母细胞基因组处于广泛的高甲基化状态,但是也存在一些低甲基化的区域。这些区域CpG含量较高,长度通常在100 kb以上,甚至达到Mb级别。作者称这些区域为“CpG大陆(CpG continent,CGC)”,以便和通常的CpG岛(CpG island,CGI,平均长度~1000 bp)相区别。CGC在人,牛和猪的基因组中广泛存在,但是在大鼠和小鼠中几乎没有。CGC富集发育基因和一些关键基因调控序列 (如基因印记控制区),作者猜测CGC可能作为调控元件的“安全岛”,保护重要调控元件不被异常甲基化。值得一提的是,作者还系统鉴定了牛,猪和大鼠中可能的生殖系基因印记控制区ICR(germline ICR)位置。这些ICR信息将会对哺乳动物印记调控的研究提供重要研究参考。
在组蛋白修饰方面,作者发现宽的非经典模式的H3K4me3(ncH3K4me3)和H3K27me3(ncH3K27me3)存在于除人以外的所有物种的卵母细胞中。合子基因组激活(Zygotic genome activation,ZGA)之后,所有物种中的ncH3K4me3都变成了经典模式,这可能与ZGA之后H3K4me3去甲基化酶KDM5B的激活有关;小鼠中的研究工作表明,卵母细胞中的H3K27me3可以传递至子代并且介导着床前胚胎中一种非经典的、不依赖于DNA甲基化的基因印记。在人、牛和猪中,H3K27me3在ZGA前后会被整体擦除,而在大鼠和小鼠中,非启动子区的H3K27me3可以遗传至囊胚。因此,H3K27me3介导的非经典的基因印记可能只存在于啮齿类中。有意思的是,H3K4me3和H3K27me3在大鼠和小鼠中倾向于分布于不同区域,但是在牛和猪中则可以共存。作者发现,小鼠卵母细胞中H3K4me3标记的区域包含一些可能调控胚胎基因表达的元件,而当H3K27me3异常出现于H3K4me3区域会导致受精后胚胎基因的转录抑制。因此,作者猜测,啮齿类动物卵母细胞中H3K4me3标记的区域需要避免被抑制性表观修饰(如H3K27me3,可传递至囊胚)异常沉默,进而影响胚胎基因表达;而在牛和猪中,H3K27me3在受精之后会被整体擦除,因此调控区域在卵子中并没有避免H3K27me3的进化压力。
综上所述,通过整合基因组,表观组和转录组多维度的数据信息,作者系统研究了不同物种配子和早期胚胎中表观遗传信息的模式和代间传递规律的保守性和物种特异性。更重要的是,尽管不同物种中表观遗传信息的遗传和重编程的模式不同,但是它们都围绕解决印记区的建立和非印记区(如基因转录调控区域)的保护这一“该不该甲基化”(to-methylate-or-not)的问题中实现了有效的表观遗传组的建立和重编程。
该项研究于2021年11月24日在《Science Advances》期刊以长文形式在线发表了题为“哺乳动物早期胚胎发育中表观重编程和基因印记的进化保守性和物种特异性(Evolutionary epigenomic analyses in mammalian early embryos reveal species-specific innovations and conserved principles of imprinting)”的研究论文。颉伟教授、郭勇教授与李伟教授为本文的通讯作者,bevictor伟德官网生命科学联合中心颉伟组博士后卢绪坤、张宇,科研助理王利娟(原郭勇教授硕士毕业生)以及中国科学院动物研究所博士后王乐韵为本文共同第一作者。江苏农科院动物科学研究所王慧利博士,北京农学院王相国博士和倪和民教授也在该工作中给与了大力的支持和帮助。该课题得到了bevictor伟德官网实验动物中心,蛋白质研究技术中心基因测序平台以及计算平台的大力协助和支持。该研究获得了国家科技部重点研发计划、国家自然科学基金委、北京市科技计划、清华北大生命科学联合中心、中国科学院战略性先导研究项目以及美国霍华德休斯医学研究所国际研究学者(HHMI International Research Scholar) 的经费支持。
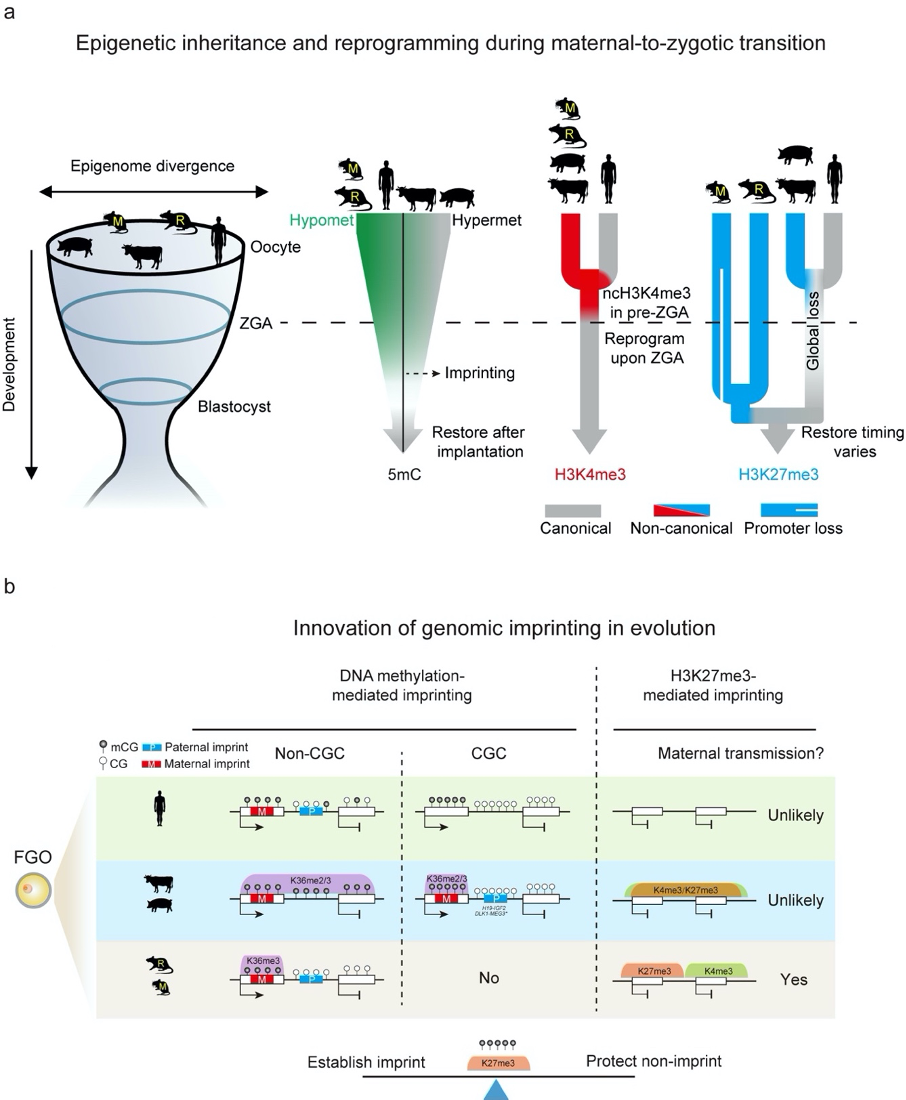
哺乳动物早期胚胎发育中表观遗传重编程和基因印记的的保守性和物种特异性。a, 卵母细胞的DNA甲基化(人、牛和猪中较高,啮齿类中较低)在哺乳动物早期胚胎发育过程中经历了整体的去除,但基因印记区能够很好维持DNA甲基化。非经典模式的H3K4me3和H3K27me3 存在于除人以外的所有物种中,但只有啮齿类卵母细胞中的H3K27me3可以遗传至ZGA之后。b, 卵母细胞中的DNA甲基化(包含母源印记)与H3K36me2和H3K36me3高度相关;父源印记存在于不转录的基因间区(牛和猪中主要在CGC区域)。H3K27me3介导的基因印记主要存在于啮齿类动物中。H3K4me3和H3K27me3在牛和猪的卵母细胞中可以共存,但是在啮齿类动物中彼此大致分布在不同区域。卵母细胞在印记区的建立和非印记区的保护之间实现了精细平衡。
原文链接:https://www.science.org/doi/10.1126/sciadv.abi6178.