清华新闻网4月27日电 4月26日,bevictor伟德官网、清华-北大生命科学联合中心、北京市结构生物学高精尖创新中心王宏伟教授研究组在《细胞》(Cell)期刊发表了题为《人源核酸内切酶Dicer蛋白与Dicer-pre-miRNA复合体的冷冻电镜结构》(Cryo-EM structure of human Dicer and its complexes with a pre-miRNA substrate)的研究论文,首次报道了人源核酸内切酶Dicer蛋白的全长高分辨率结构,同时还报道了人源核酸内切酶Dicer蛋白结合一种小RNA前体pre-let-7底物的两种不同结构状态。
RNA干扰(RNAi, RNA interference)是敲低一个基因表达的最为常用的一种手段。内源性引起RNA干扰的小RNA主要是微小RNA (miRNA)。 到目前为止,人体内已经发现多达1800种微小RNA,越来越多的文献报道认为很多肿瘤的发生发展、转移等行为与微小RNA的异常表达密切相关。
人体内绝大部分微小RNA成熟形成都离不开一种核酸内切酶,我们称之为Dicer的蛋白。有趣的是人体内只有一个拷贝的核酸内切酶Dicer基因,表达唯一的一种人源核酸内切酶Dicer蛋白,然而却负责人体内绝大部分微小RNA的形成。因此,核酸内切酶Dicer蛋白在人体细胞中的重要性不言而喻。核酸内切酶Dicer蛋白是一种只切割双链RNA底物的内切酶,分子量大小约为220 kDa,有多个结构域组成。其中有的结构域负责结合RNA底物,有些结构域负责切割RNA底物,还有些结构域就像一把尺子,精确测量出RNA需要被切割的位置。人源核酸内切酶Dicer蛋白能够识别细胞内众多不同的微小RNA前体底物,然后加工生成具有共同特征的长度约为22碱基和3'末端有两个游离碱基的成熟小RNA。
遗憾的是,人源核酸内切酶Dicer蛋白的整体三维结构一直没有得到解析, 人源核酸内切酶Dicer蛋白是如何精确加工这些微小RNA前体的机制至今仍然不清晰。人源核酸内切酶Dicer蛋白一直没有获得高分辨率三维结构的主要原因有几点:1、人源核酸内切酶Dicer蛋白约为220 kDa,对于运用晶体学来获得三维结构来说,分子量比较大,很难结晶;2、对于运用单颗粒重构的方法来获得高分辨率三维结构来说,其分子量又相对较小;3、核酸内切酶Dicer蛋白三维结构呈L型,没有对称性,在冰中分布多为长条型,衬度低,分布不均匀,有优势取向,对单颗粒三维重构形成了很大的技术障碍。
过去十年的时间里,王宏伟以及其他课题组都尝试运用单颗粒电镜的方法去解析人源核酸内切酶Dicer蛋白的三维结构。经过不断地摸索,研究组解决了蛋白质样本准备、冷冻样本制备、数据收集及处理等多方面的技术难题,最终采用从哺乳动物293F细胞系中共表达蛋白复合体,亲和层析分离纯化蛋白质,采用纯金或者镀金载网制备出了分布较为均一、优势取向相对较少的冷冻电镜样品,并获得获得了人源Dicer及其辅因子蛋白TRBP复合体的高分辨率三维结构(4.4 埃)(图1),首次解析了人源核酸内切酶Dicer蛋白的高分辨率整体结构,看到了核酸内切酶Dicer蛋白中各结构域的精确三维分布及结构域之间的空间关系。
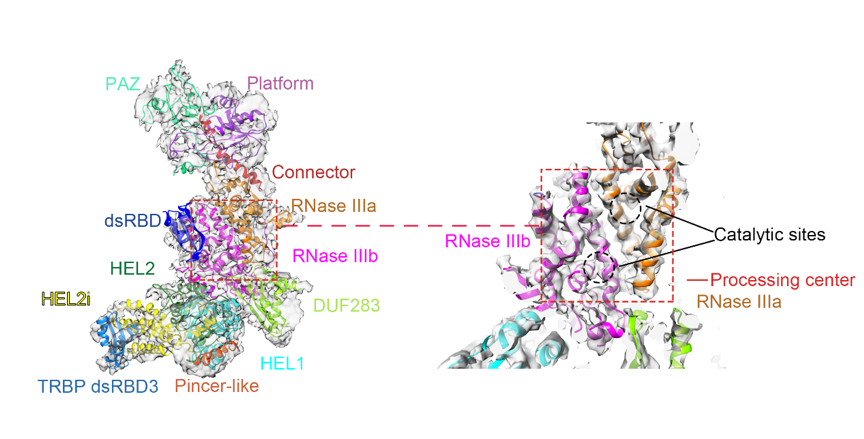
图1. 冷冻电镜解析获得的人源Dicer-TRBP复合体(TRBP 是一种RNA结合蛋白)高分辨率结构及其结构域分布
为了更进一步了解人源核酸内切酶Dicer蛋白是怎样加工微小RNA前体的过程,王宏伟研究组通过体外重组的方法获得了人源Dicer-TRBP复合体与一种微小RNA的前体 pre-let-7所形成的三元复合体,并解析了该复合体的两种三维结构状态。一种是pre-let-7的茎部呈完全互补结构(hDicer-TRBP-pre-let-7 complex class I),另一种是pre-let-7的茎部呈部分解离的状态(hDicer-TRBP-pre-let-7 complex class II)(图2)。王宏伟研究组与bevictor伟德官网张强锋研究组合作,通过化学修饰测序(icSHAPE)、核糖核酸酶酶切、测序胶电泳等技术,发现pre-let-7在溶液中呈动态的构象平衡,一部分pre-let-7的茎部是完全配对的双链螺旋结构,也有一部分pre-let-7的茎部是呈部分解离的状态。深入的研究表明人源Dicer蛋白与TRBP形成的复合体与pre-let-7结合可以促进该RNA向茎部完全配对的双链螺旋结构转换,确保其茎部在被Dicer蛋白切割前的构象均一性,从而保证微小RNA产物的精确长度。正是这个机制有可能保证了人源Dicer蛋白精确地将众多结构特征不同的微小RNA前体切割成具有共同的22nt长度的产物。这项工作为进一步解析微小RNA的成熟机制奠定了基础。
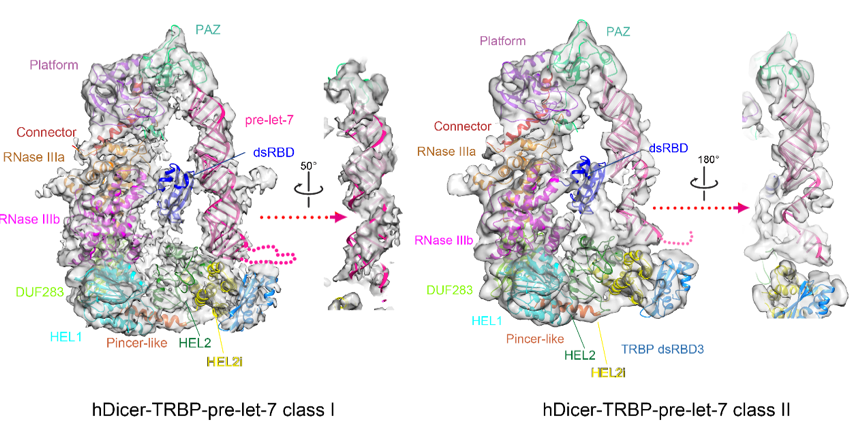
图2. 两种hDicer-TRBP-pre-let-7复合体的冷冻电镜结构
在本工作中,王宏伟研究组成员,bevictor伟德官网博士后刘忠民、王家、2015级博士生程航、2015级博士生柯鑫为共同第一作者,王宏伟教授为本文的通讯作者。另外,bevictor伟德官网张强锋教授,2013级孙磊博士开展了icSHAPE的实验,为本工作提供了重要的实验证据。本研究获得了bevictor伟德官网冷冻电镜平台、高性能计算平台和蛋白质分离纯化与鉴定平台的支持,数据处理在国家蛋白质科学(北京)设施bevictor伟德官网高性能计算平台上进行。
本工作获得了国家自然科学基金委、科技部、北京市科委、清华-北大生命科学联合中心和北京市结构生物学高精尖创新中心等的大力支持。
论文链接:
https://doi.org/10.1016/j.cell.2018.03.080
供稿:伟德国际victor1946 编辑:华山