肿瘤细胞的免疫反应活性在肿瘤的发生发展中扮演了重要角色,其直接影响肿瘤微环境塑造及肿瘤细胞的免疫原性,是决定肿瘤免疫治疗敏感性与耐受性的重要因素。2018年8月29日,bevictor伟德官网杨雪瑞研究组在The EMBO Journal发表文章Function of HNRNPC in breast cancer cells by controlling the dsRNA-induced interferon response(http://dx.doi.org/10.15252/embj.201899017),首次报道调控RNA剪接的关键蛋白HNRNPC是抑制乳腺癌细胞干扰素信号通路并维持肿瘤细胞快速增殖的核心蛋白。抑制HNRNPC表达量导致乳腺癌细胞内源双链RNA(endogenous dsRNA)的大量积聚,进而激活一系列下游免疫反应,产生显著的抑癌效果。本研究工作首次将RNA异常剪接与双链RNA激活的干扰素信号通路联系在一起,提出了内源RNA调控肿瘤细胞免疫反应活性的新机制。
核不均一核糖核蛋白C(HNRNPC)是细胞中广泛表达的一个重要RNA结合蛋白,大量文献报道其对RNA剪接过程中内含子(intron)的剪切与外显子(exon)的正确组装起着关键作用。HNRNPC在多种类型的肿瘤细胞中高表达,但其维持肿瘤细胞生理功能的作用及分子机制尚不明确。在此前的工作中,杨雪瑞实验室对The Cancer Genome Atlas (TCGA) 中大规模乳腺癌队列转录组数据进行了深入挖掘,结果显示HNRNPC有调控mRNA代谢与降解的功能。在此线索的指引下,他们在乳腺癌细胞MCF7和T47D中进行了一系列实验研究,发现敲低HNRNPC激活了肿瘤细胞中I型干扰素的产生,导致细胞内强烈的免疫反应,显著抑制了细胞增殖与肿瘤生长。
细胞内干扰素反应有多种激活方式,其中最主要的诱因是来自病原微生物(病毒、细菌等)的外源RNA或DNA。在特定条件下,来源于细胞自身的内源RNA或DNA也可以激活干扰素信号通路。在肿瘤免疫学领域,近年来有多项重要工作发现肿瘤细胞基因组中的内源性逆转录病毒(ERV)可以被一些抗肿瘤药物(如DNMT抑制剂或CDK4/6抑制剂)激活,其转录产物可以形成双链RNA,诱发肿瘤细胞内的干扰素信号。更重要的是,肿瘤细胞内免疫反应的激活可以大幅提高肿瘤免疫治疗(如PD-1/PD-L1抑制剂)的有效性(Chiappinelli, Cell 2015; Goel, Nature 2017; Roulois, Cell 2015)。
杨雪瑞实验室的三位博士生武玉胜、赵文溦与刘阳发现,在乳腺癌细胞中敲低HNRNPC所导致的免疫反应同样由细胞内源双链RNA导致。但通过对这些双链RNA的深度测序分析,他们意外地发现这些双链RNA与以上文献中介绍的ERV无关,而是主要来源于基因组中包含Alu重复序列的大量内含子序列。
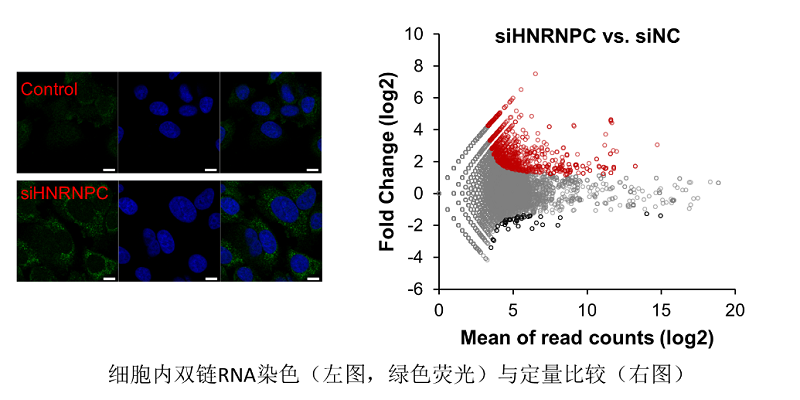
基因组中包含大量Alu或Alu片段的重复序列,蛋白编码基因的内含子区同样有大量Alu。正常的RNA剪接机制会将这些Alu内含子排除在成熟的mRNA分子之外,而HNRNPC在此过程中扮演了重要的把关者的角色。杨雪瑞实验室的研究证明当HNRNPC表达量不足以维持正常的RNA剪接时,许多Alu内含子序列会保留在成熟的mRNA分子中并被转运出核。这些mRNA不能被正常翻译,因此会激活无义介导的RNA降解(nonsense-mediated decay,NMD)。Alu序列在这些mRNA中往往以双链RNA结构的形式存在,而这些双链RNA结构通常比较难于被降解,因此当其所在的异常mRNA分子被各种内切及外切酶处理以后,Alu序列被保留下来,成为细胞内独立存在的小片段双链RNA并大量累积,最终直接诱发了肿瘤细胞内干扰素信号通路,激活下游免疫反应。
综上所述,杨雪瑞课题组这一研究首次发现肿瘤细胞内的RNA异常剪接可以产生一类新的具有免疫活性的内源双链RNA,并通过深入的实验研究与数据分析详细阐明了该过程复杂的分子机制。相对于正常细胞,肿瘤细胞为实现快速增殖、分化等功能,需要维持快速的基因转录、翻译等过程,因此对RNA生成过程的质控提出了更高的要求。杨雪瑞实验室的研究详细阐明了HNRNPC作为RNA剪接过程的关键质控机制对于肿瘤细胞的重要意义。更重要的是,研究证明了对该质控过程的干扰导致了一个出人意料的结果:肿瘤细胞内免疫反应的激活。这一研究成果也启发了更多肿瘤免疫相关的科学问题,有望为提高肿瘤免疫治疗有效性的策略提供全新的思路。
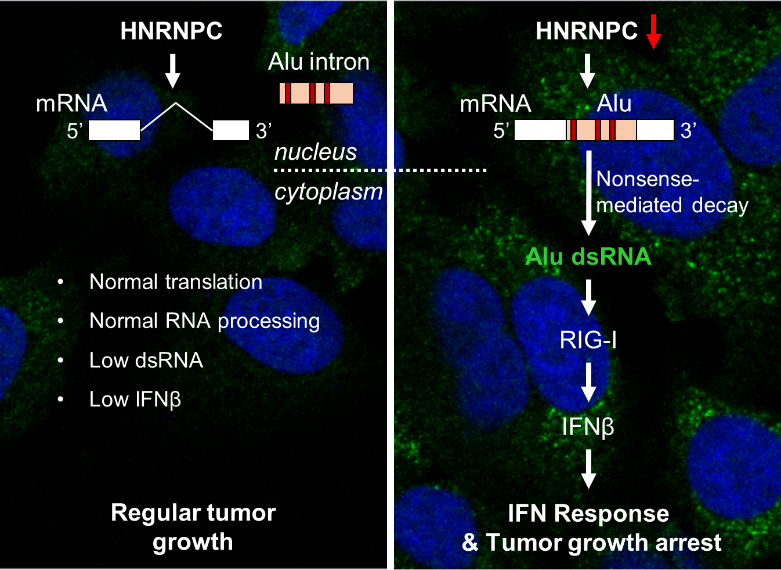
研究成果示意图
伟德国际victor1946杨雪瑞研究员为本文的通讯作者。CLS项目博士生武玉胜、bevictor伟德官网博士生赵文溦、PTN项目博士生刘阳为本文共同第一作者。本研究由国家重点研发计划“精准医学研究”重点专项、国家自然科学基金委、清华-北大生命科学联合中心、bevictor伟德官网自主科研项目提供经费支持。bevictor伟德官网蛋白质研究技术中心基因测序平台、生物计算平台、shRNA文库、细胞功能与影像平台及实验动物中心对本课题的研究提供了大力支持。
文章链接:http://emboj.embopress.org/content/early/2018/08/29/embj.201899017
参考文献:
Chiappinelli, K.B., Strissel, P.L., Desrichard, A., Li, H., Henke, C., Akman, B., Hein, A., Rote, N.S., Cope, L.M., Snyder, A., et al. (2015). Inhibiting DNA Methylation Causes an Interferon Response in Cancer via dsRNA Including Endogenous Retroviruses. Cell 162, 974-986.
Goel, S., DeCristo, M.J., Watt, A.C., BrinJones, H., Sceneay, J., Li, B.B., Khan, N., Ubellacker, J.M., Xie, S., Metzger-Filho, O., et al. (2017). CDK4/6 inhibition triggers anti-tumour immunity. Nature 548, 471-475.
Roulois, D., Loo Yau, H., Singhania, R., Wang, Y., Danesh, A., Shen, S.Y., Han, H., Liang, G., Jones, P.A., Pugh, T.J., et al. (2015). DNA-Demethylating Agents Target Colorectal Cancer Cells by Inducing Viral Mimicry by Endogenous Transcripts. Cell 162, 961-973.