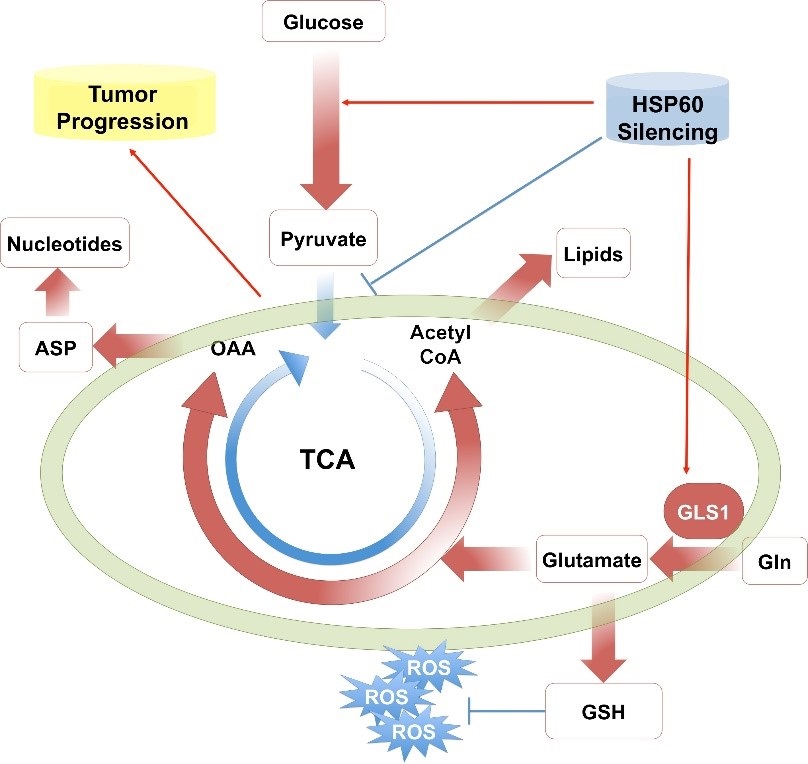
肾透明细胞癌(Clear cell renal cell carcinoma, ccRCC)是肾癌中最主要的一种亚型,具有典型的Warburg表型。伟德国际victor1946邓海腾课题组的早期工作发现线粒体的损伤促进ccRCC细胞的增殖和转移,但是线粒体在ccRCC的发生发展中发挥什么样的功能一直是一个没有解决的问题。2019年5月13日,该课题组与国家蛋白质科学研究(北京)设施清华基地蛋白质组学和代谢组学平台合作在《氧化还原生物学》(Redox Biology)杂志在线发表题目为“HSP60敲低促进ccRCC细胞瓦博格效应并将线粒体功能从ATP生成转变为的生物合成”(HSP60 Silencing Promotes Warburg-like Phenotypes and Switches the Mitochondrial Function from ATP Production to Biosynthesis in ccRCC Cells)的研究论文。该研究利用稳重同位素示踪技术结合代谢组学、蛋白质组学等方法揭示了HSP60敲低通过促进肾透明细胞癌细胞线粒体的谷氨酰胺代谢来促进癌细胞的生长,提示抑制谷氨酰胺代谢是肾透明细胞癌的一个治疗靶标。
HSP60是维持线粒体稳态的重要分子。该课题组的前期工作发现HSP60在肾透明细胞癌中低表达,并且敲低HSP60能够促进肾透明细胞癌细胞的生长。利用稳重同位素13C标记的谷氨酰胺或葡萄糖追踪HSP60敲低后肾透明细胞癌细胞的代谢物变化,他们发现HSP60敲低加强了ccRCC细胞的Warburg效应,糖酵解过程增强而线粒体氧化磷酸化提供的ATP减少;同时13C5-谷氨酰胺示踪结果显示HSP60敲低加强了线粒体利用谷氨酰胺进行核糖核酸、脂质、谷胱甘肽的合成能力,而谷胱甘肽的增加通过降低细胞的活性氧分子水平加快细胞的生长。 进一步的研究发现,MEK/ERK/c-MYC信号通路的激活上调谷氨酰胺酶的表达,而抑制谷氨酰胺酶或降低谷氨酰胺水平都明显抑制ccRCC细胞的增殖。
伟德国际victor1946CLS项目博士生滕瑞芳为本文的第一作者,伟德国际victor1946邓海腾为本文通讯作者,国家蛋白质科学研究(北京)设施清华基地蛋白质组学与代谢组学平台主管刘晓蕙,阜外医院国家心血管疾病重点实验室宋江平为共同通讯作者。该研究获得了国家自然科学基金委和科技部973项目的资助。
在另一项研究中,邓海腾课题组和蛋白质组学平台合作对BAP1基因在ccRCC发生发展中的功能进行系统的研究。10%的ccRCC患者存在BAP1基因突变,而且BAP1突变和患者生存期负相关。那么在90%不携带BAP1突变的ccRCC患者中,BAP1是否也发挥抑癌基因的功能?2019年4月16日,该课题组在Molecular & Cellular Proteomics杂志上在线发表了题为“Loss of BAP1 Results in Growth Inhibition and Enhances Mesenchymal-Epithelial Transition in Kidney Tumor Cells”的研究论文。通过分析TCGA数据,他们发现BAP1的低表达和ccRCC患者的生存期正相关,提示Wildtype BAP1可能发挥促癌基因的功能。利用BAP1敲除的ccRCC细胞系,他们揭示BAP1缺失后差异表达蛋白主要富集在细胞形态和细胞生长相关的通路。泛素化组学结果提示BAP1参与了RNA加工、染色质重组等生物学过程。功能性实验证实BAP1敲除降低蛋白合成和Rho GTPase的活性,导致细胞增殖变慢以及细胞伪足、胞内微丝束的减少。BAP1缺失显著降低ccRCC细胞的迁移和侵袭能力以及EMT相关蛋白Vimentin、N-cadherin和转录因子Snail的表达。ChIP实验结果显示BAP1敲除增加Snail基因区域H2AK119的泛素化水平,并且加强Snail-promoter的活性。这些结果表明BAP1通过对H2A的去泛素化调控了Snail基因的转录和EMT过程,提示在携带Wildtype BAP1的病人中BAP1可能发挥促癌作用。
伟德国际victor1946博士生陈鹏晟为本文的第一作者,伟德国际victor1946邓海腾为本文通讯作者,301医院的吴迪和吕阳参与了该项工作。该研究获得了国家自然科学基金委和科技部973项目的资助。