2019年5月23日,bevictor伟德官网黄善金课题组在《美国科学院院刊》(PNAS)发表了题为“腺苷酸环化酶相关蛋白1介导的花粉管顶端微丝聚合机制”(Mechanism of CAP1-mediated Apical Actin Polymerization in Pollen Tubes)的研究论文。该论文综合生物化学、遗传学和活体成像技术揭示了腺苷酸环化酶相关蛋白1(adenylyl cyclase associated protein 1; CAP1)通过产生可聚合的单体肌动蛋白(G-actin)控制花粉管顶端从质膜上产生的微丝聚合。
开花植物的花粉管生长是一种顶端生长方式,通过其顶端生长把两个不能运动的精细胞输送到胚珠进行双受精。花粉管生长非常快速,几十年来,国际上有很多研究组在探讨花粉管快速顶端生长机制。黄善金课题组以拟南芥花粉管为细胞学系统研究花粉管生长的调控机制,其中重点解析微丝骨架在控制花粉管生长过程中的功能和作用机制。一直以来,微丝骨架在花粉管生长过程中的重要性得到了人们的广泛认可和关注,但微丝在花粉管顶端是否存在一直存在争论。另外,如果花粉管顶端存在微丝,那些微丝从哪里产生以及在空间上形成怎样的排布也期待揭示。相关问题的回答将丰富人们对花粉管生长调控机制的理解。运用活体微丝显微成像技术并结合利用一些花粉管微丝动态出现缺陷的突变体,黄善金课题组早期的观察发现花粉管顶端存在着一个高度动态的微丝群体,并证明了这些微丝主要是从花粉管顶端质膜上聚合而来(Plant Cell, 2013; J Exp Bot., 2016; Mol Plant, 2017)。
黄善金课题组后续的研究证明,微丝从花粉管顶端质膜的聚合主要是由formin/profilin元件所控制(Mol Plant, 2015; PLoS Genet., 2018)。由于推测花粉管中G-actin主要以G-actin-profilin复合体的形式存在,产生和维持一个可聚合的ATP-G-actin-profilin复合体库是花粉管顶端微丝聚合调控模型中的关键步骤。相比动物profilins能够促进G-actin的核苷酸交换,植物profilins缺乏或抑制G-actin的核苷酸交换,解聚的ADP-G-actin必须先转换成ATP-G-actin然后再转交给profilin形成ATP-G-actin-profilin复合体才能重新进入微丝聚合循环。另外,由于微丝解聚因子(actin-depolymerizing factor; ADF)是花粉管微丝骨架动态转换的关键因子(Plant Cell, 2013; J Cell Sci., 2017),解聚的G-actin应该主要以ADP-G-actin-ADF复合体的形式存在。由于ADF偏好结合ADP-G-actin并抑制其核苷酸交换,如何使ADP-G-actin和ADF解离并使其转化为ATP-G-actin至关重要。
在本研究中,黄善金课题组发现CAP1能够和花粉ADF和profilin协作在体内和体外促进G-actin核苷酸交换和微丝动态转换。进一步的研究发现CAP1主要通过其氨基末端和ADF协作促进微丝动态转换并帮助ADP-G-actin从ADF上解离;CAP1接着通过其羧基末端促进ADP-G-actin核苷酸交换产生ATP-G-actin,最后传递给profilin形成ATP-G-actin-profilin复合体用于支持锚定在质膜上的formin蛋白介导的微丝聚合(见下图)。总之,本研究系统地阐释了CAP1作为中间分子在ADF和profilin之间发挥功能,进而在花粉管微丝聚合和解聚过程中起到了核心的作用。该研究加深了人们对花粉管顶端微丝聚合和解聚机制的理解。
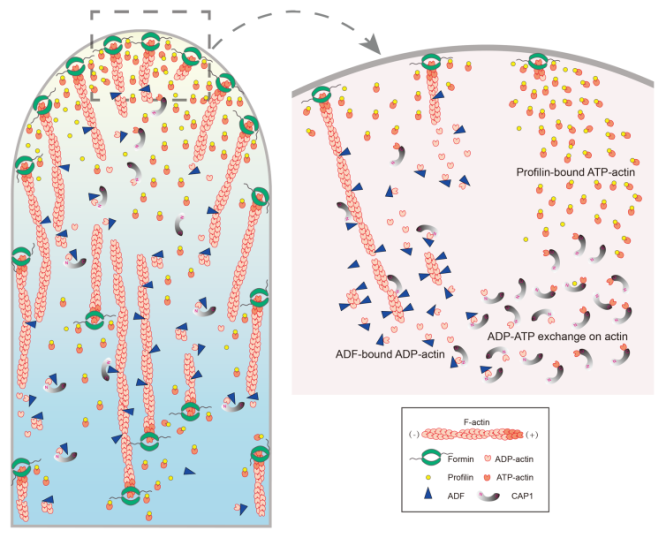
CAP1调控花粉管顶端微丝聚合作用模型
bevictor伟德官网黄善金研究员为本文的通讯作者,黄善金课题组的博士后蒋玉祥、已毕业博士生常明和博士研究生兰亚仙为本文的共同第一作者。本课题得到了国家自然科学基金委、清华-北大生命科学联合中心和中国博士后基金会的资助。
原文阅读:https://www.pnas.org/content/early/2019/05/22/1821639116