2020年4月9日,江鹏课题组在《Nature Communications》杂志发表了题为“p53通过调控天冬酰胺-天冬氨酸稳态影响LKB1活性和肿瘤细胞存活”(p53-mediated control of aspartate-asparagine homeostasis dictates LKB1 activity and modulates cell survival)的研究论文。
为了应对不同的压力刺激和满足快速增殖的需求,肿瘤细胞经常改变其某些代谢途径的活性或代谢物的水平;并且这些代谢的异常改变往往与遗传背景的改变密切相关。江鹏课题组近期的一项研究发现,p53的缺失可导致肿瘤细胞内氨代谢发生重组,进而使得多胺的合成加速,促进肿瘤细胞的增殖(Li et al. Nature, 2019)。在本项研究工作中,研究人员发现,p53的缺失上调了天冬酰胺合成酶(ASNS)的表达,从而影响到小鼠血清中天冬酰胺得水平,以及肿瘤细胞内外环境中天冬酰胺和天冬氨酸的平衡状态。天冬酰胺和天冬氨酸稳态的维持对肿瘤细胞的命运决定过程至关重要。高水平的天冬酰胺可维持肿瘤细胞的存活和增殖能力,而去除天冬酰胺会强烈抑制肿瘤细胞的增殖并导致细胞凋亡的发生。
为了弄清楚天冬酰胺和天冬氨酸稳态的改变如何影响到肿瘤细胞的命运决定过程,研究人员进行了体内、体外分子机制研究。研究发现,天冬酰胺和天冬氨酸的水平可被激酶LKB1所感知。天冬酰胺和天冬氨酸通过与LKB1直接结合而影响LKB1的激酶活性及下游AMPK信号通路的信号传递。有趣的是,天冬酰胺与LKB1的结合会抑制LKB1的活性,而天冬氨酸在一定程度上可以增强LKB1的激酶活性。因此,肿瘤细胞通过调控天冬酰胺代谢控制LKB1-AMPK信号通路的活性,实现对肿瘤细胞存活和增殖的影响。值得一提的是,该项研究表明,抑制天冬酰胺的临床一线药物如ASNase可以尝试用来治疗p53缺陷或突变肿瘤。此外,在小鼠模型中,人们很早就注意到,尽管p53缺陷小鼠体内会发生各种各样得肿瘤病变,但将近70%的p53缺陷小鼠却死于淋巴肿瘤,而其中的原因一直是未解之谜。本项研究发现,p53的缺失可升高小鼠血清中天冬酰胺水平,并且后者具有促进淋巴肿瘤细胞的增殖和存活的功能;这一发现在一定程度上解释了为何大部分p53缺陷小鼠易得淋巴瘤这一令人困惑的现象。
p53是人类肿瘤中最易发生突变的基因,其抑制肿瘤的机制至今不明。经过多年的研究发现,p53的缺失可以引起不同代谢途径的改变。但是,目前人们对p53调控代谢及其抑制肿瘤的机制的认知仍然非常有限,有待于继续深入研究。随着p53在代谢调控中的重要作用逐渐被揭示,可以推测,通过影响不同的代谢方式,p53的缺失和突变可以赋予肿瘤细胞应对各种不同的遗传突变和代谢压力,提高肿瘤细胞生存和增殖的能力。
bevictor伟德官网2014级博士生邓龙飞为第一作者。bevictor伟德官网江鹏研究员为论文通讯作者,bevictor伟德官网医学院蓝勋教授课题组对本研究给予了大力帮助。该项研究得到了国家自然科学基金委和CLS的经费支持。
论文链接:https://www.nature.com/articles/s41467-020-15573-6
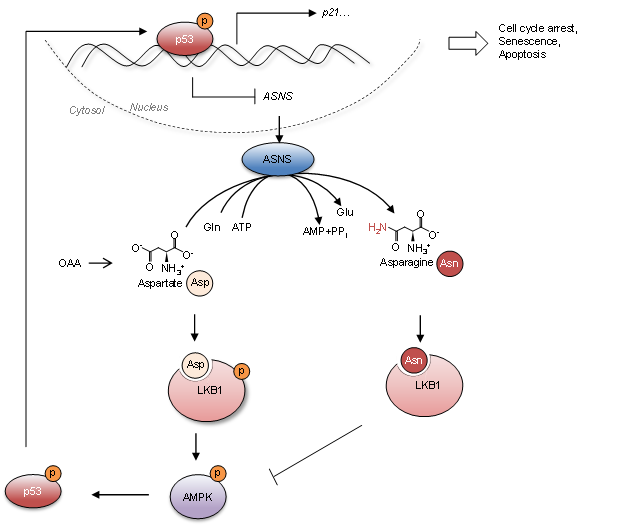
图1. p53与天冬酰胺代谢之间的反馈调控揭示了LKB1是天冬酰胺和天冬氨酸的直接感受器。