2020年6月17日,伟德国际victor1946王新泉教授研究组在《自然通讯》(Nature Communications)在线发表题为《HKU2和SADS-CoV刺突蛋白的冷冻电镜结构为冠状病毒的进化提供了线索》(Cryo-EM structures of HKU2 and SADS-CoV spike glycoproteins provide insights into coronavirus evolution)的研究论文。猪冠状病毒SADS-CoV于2017年在中国广东的几家猪场被发现,其基因组与蝙蝠冠状病毒HKU2的同源性约为95%。本文报道了HKU2和SADS-CoV刺突蛋白三聚体2.38 A和2.83 A辨率的冷冻电镜结构(图一),并系统地比较了HKU2/SADS-CoV与其他α、β、γ和δ冠状病毒刺突蛋白中的各个结构域,表明HKU2/SADS-CoV的NTD和CTD分别代表了冠状病毒刺突蛋白的原始特征。这些结果在结构上揭示了HKU2/SADS-CoV(属于α冠状病毒属)与β冠状病毒属之间的密切进化关系,为冠状病毒的进化和跨物种传播提供了重要的线索。
冠状病毒包括α、β、γ和δ四个属,在人类、其他哺乳动物和鸟类中的感染可引起不同程度的呼吸、消化和神经系统疾病。人SARS、MERS和新型冠状病毒的传播对全球健康构成了严重威胁。冠状病毒感染也是家畜养殖业的重要威胁,以猪流行性腹泻病毒(PEDV)为代表的猪冠状病毒每周夺去10万只仔猪的生命,同时新型猪冠状病毒也在不断被发现,例如2017年分离的猪急性腹泻综合征冠状病毒(SADS-CoV,又称SeACoV和PEAV)在中国广东省的几家养猪场引起了仔猪严重水样腹泻,死亡率高达90%,造成了大量的经济损失。SADS-CoV是一种α属冠状病毒,在α属中具有代表性的成员有猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎冠状病毒(TGEV)、猪呼吸道冠状病毒(PRCV)、猫传染性腹膜炎病毒(FIPV)、人NL63和229E冠状病毒(HCoV-NL63和HCoV-229E);β属的代表性成员包括小鼠肝炎冠状病毒(MHV)、牛冠状病毒(BCoV)、SARS-CoV、MERS-CoV、HCoV-OC43、HCoV-HKU1和新型冠状病毒;γ属的代表是禽传染性支气管炎病毒(IBV);δ属的代表是猪源deltacoronavirus(PdCoV)。
通过基因重组和/或突变促进的跨物种传播是冠状病毒宿主范围扩大的基础。蝙蝠是多种不同的α-和β-冠状病毒的自然宿主,它们通过重组和/或突变带来巨大的种间传播潜力。有关基因进化、受体结合和发病机制的数据表明,人类SARS-CoV-2、SARS-CoV和MERS-CoV最有可能来源于蝙蝠。新鉴定的猪SADS-CoV与蝙蝠冠状病毒HKU2的序列同源性约为95%,这也进一步强调了冠状病毒跨种传播的严重后果。
SADS-CoV刺突蛋白(1130个氨基酸残基)和HKU2刺突蛋白(1128个氨基酸残基)是最短的冠状病毒刺突蛋白之一,它们与其他已知冠状病毒刺突蛋白的氨基酸序列同源性低于28%,表明HKU2和SADS-CoV在进化中的特殊性。通过原子分辨率水平的冷冻电镜结构测定和比较,王新泉实验室发现α-冠状病毒刺突蛋白NTD有两种亚型,HKU2/SADS-CoV的NTD属于I亚型,而HCoV-229E的NTD属于II亚型,这两个亚型代表了NTD的原始结构,可能是其他属冠状病毒NTD的进化祖先。HKU2/SADS-CoV的CTD是一个包含5个反向排列strand的单层β-sheet,β-冠状病毒的CTD也具有类似的单层核心结构,目前已知的β-冠状病毒CTD的受体结合序列都在一个插入核心结构中的受体结合区(receptor-binding motif,RBM)内,但RBM在HKU2/SADS-CoV的 CTD中被一段短loop取代(图二)。该结果说明HKU2/SADS-CoV的CTD代表单层CTD的原始结构,而β-冠状病毒中RBM的插入可能是进化过程中重组事件的结果。值得注意的是,来自其他α-冠状病毒、γ-冠状病毒IBV和δ-冠状病毒PdCoV的CTD均由两层β-sheet组成的双层亚型(图二)。这些结果进一步证明HKU2可能是α-冠状病毒基因组骨架与未鉴别的原始β-冠状病毒的刺突蛋白基因进行重组的结果。
通过比较HKU2和SADS-CoV与其他冠状病毒刺突蛋白的结构,王新泉实验室发现在进化过程中,多个NTD可以重组进入同一个冠状病毒中(主要表现在α-冠状病毒),额外的loop区可以重组进入NTD的核心结构,受体结合区(RBM)可以重组进入CTD的核心结构。这些现象表明,结构域在进化过程中可以逐渐招募新的亚结构域,以进行跨物种传播并适应不同的宿主免疫系统,为病毒与宿主的协同进化提供了一个生动的例子。
伟德国际victor1946王新泉教授研究组的博士生余锦芳为本文第一作者,谯淑元和郭润域为共同作者,王新泉教授为通讯作者。电镜数据采集和计算工作在国家蛋白质科学研究(北京)设施的冷冻电镜平台和生物计算平台完成。本工作获得北京市结构生物学高精尖创新中心、北京市生物结构前沿研究中心、bevictor伟德官网自主科研基金、蛋白质科学教育部重点实验室、科技部重大科学研究计划专项和国家自然科学基金等的大力支持。
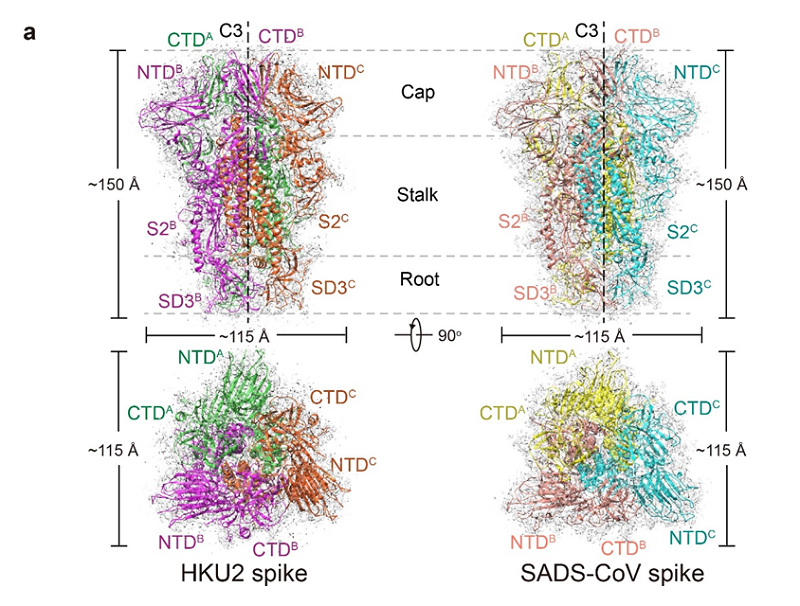
图一、HKU2和SADS-CoV的刺突蛋白三维结构
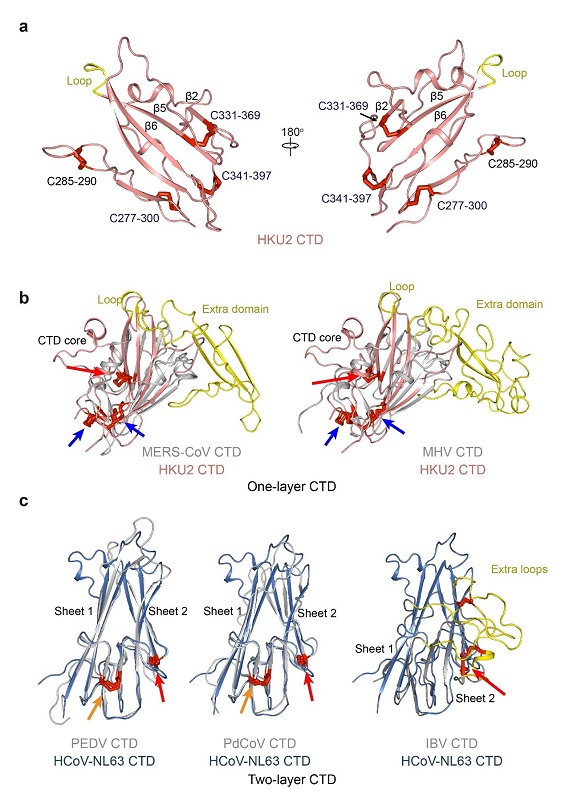
图二、HKU2与其他种属冠状病毒CTD的比较
论文链接:https://www.nature.com/articles/s41467-020-16876-4#Ack1